Informacja do zadania 7 i 8.
Większość pierwiastków z nielicznymi wyjątkami dąży do tego aby osiągnąć oktet elektronowy, czyli uzyskać w powłoce walencyjnej 8 elektronów, wtedy pierwiastek jest stabilniejszy. W tym celu pierwiastki mogą oddawać lub przyjmować elektrony. W większości przypadków możemy ustalić maksymalną i minimalną liczbę elektronów jaką pierwiastek może oddać lub przyjąć po analizie konfiguracji elektronów walencyjnych pierwiastka.
Stopień utleniania czyli formalna wartość ładunku atomu jest wyższy gdy atomy oddają elektrony natomiast niższy przy przyjmowaniu elektronów.
Zadanie 7. (0-2pkt)
Przedstaw w postaci klatkowej konfigurację elektronów walencyjnych Selenu a następnie ustal minimalny i maksymalny stopień utlenienia pierwiastka.
Zadanie 8. (0-2pkt)
Na podstawie powyższych informacji:
8.1. Zapisz wzór cząsteczki składającej się z Selenu i wodoru wiedząc, że Selen przyjmuje w tym związku swój najniższy stopień utlenienia.
…………………………………………………………………………………………………….
8.2. W formie cząsteczkowej zapisz reakcję otrzymywania kwasu selenowego (IV) wiedząc, że jest analogiczny do kwasu siarkowego (IV)
…………………………………………………………………………………………………….
Odpowiedzi:
Zadanie 7. (0-2pkt)
Przedstaw w postaci klatkowej konfigurację elektronów walencyjnych Selenu a następnie ustal minimalny i maksymalny stopień utlenienia pierwiastka.
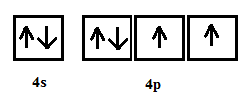
Selen zawiera 34 elektrony w tym 6 walencyjnych, powłok będzie miał 4. Zapiszmy więc konfigurację elektronów walencyjnych:
Największa wartość stopnia utleniania: +VI (może oddać 6 elektronów aby uzyskać oktet)
Najmniejsza wartość: – II (tyle może maksymalnie przyjąć aby uzyskać oktet)
Zadanie 8. (0-2pkt)
Na podstawie powyższych informacji:
8.1. Zapisz wzór cząsteczki składającej się z Selenu i wodoru wiedząc, że Selen przyjmuje w tym związku swój najniższy stopień utlenienia.
SeH2
8.2. W formie cząsteczkowej zapisz reakcję otrzymywania kwasu selenowego (IV) wiedząc, że jest analogiczny do kwasu siarkowego (IV)
SeO2+ H2O→ H2SeO3
Jest to analogiczna reakcja do otrzymywania kwasu siarkowego (IV) : SO2+H2O -> H2SO3
Zbiór zadań maturalnych:
- https://matura biomist pl/przedstaw-postaci-klatkowej-konfiguracje-elektronow-walencyjnych-selenu/1695