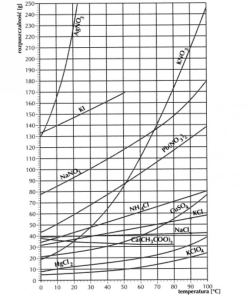
Tabela rozpuszczalności soli potrzebna do zadań :
Zadanie 1
Zmieszano ze sobą dziewięciowodny azotan żelaza (III) z wodą w pewnych proporcjach masowych i uzyskano 2 kg roztworu 24%. Oblicz proporcje masowe, z jaką zmieszano dany hydrat z wodą.
Odpowiedź
M H2O = 18 g/mol
M Fe(NO3)3 = 242 g/mol
CpH = 242/(242+9*18) * 100% = 60%
X – masa hydratu
Y – masa wody
X * 60% + y * 0% = 2000 * 24 %
60x = 48000 / : 60
X = 800 g
2000 – 800 = 1200 H2O
mH/mw = 2/3
Zadanie 2
a) stężenie masowe
b) stężenie procentowe
c) stosunek objętościowy CO2 do H2O
Odpowiedź
Mr = ms – mw
Mw = 120 – 20 = 100 g
100g = 0,1 dm3
b) Cp = 20/120 * 100% = 16,67%
c )MCO2 = 44 g/mol
44 g —– 1 mol —— 22,4 dm3
20 g ——————— x dm3
X = 10,18 dm3
10,18/0,1 = 101,8 : 1
CO2 :H2O
Zadanie 3
a) rozpuszczalność powstałej substancji
b) objętość wody użytej do reakcji ( wynik podaj w cm3)
c) Oblicz 1) masę,2) objętość 3) liczbę cząsteczek wydzielonego gazu
Odpowiedź
Cp = 15%
a) M Na = 23 g/mol M NaOH = 40 g/mol
2 *23g —— 2* 40g
5g ———- X g
X = 8,7 g
Ms = 8,7 g
Mr = (100%*ms)/Cp = (100%*8,7)/15 = 58 g
Mr = mw + ms => mw = mr-ms
Mw = 58 – 8,7 = 49,3 g
49,3 g —- 8,7 g
100g —– x g
X = 17,65 g
Odp : rozpuszczalność tej substancji wynosi 17,65 g.
b) 49,3g = 49,3 cm3
c) 2* 23 ——— 6,02 *1023 cząsteczek H2 —————- 22,4 dm3 ————- 2g
5 g ————- x ————– y ————— z
X = 6,54 * 1022 cząsteczek H2 y = 2,43 dm3 z = 0,22g
Zadanie 4
Odpowiedź
Ms1 = (Cp*mr)/(100%) = 24 g
X – masa dodanej zasady potasowej
120 g * 20% + x * 100% = (120 + x)*35%
2400 + 100x = 4200 + 35x
65x = 1800 / : 65
X = 27,7 g
Mr2 = mr1 + x = 147,7 g
Mw = mr – ms1 = 96 g
96 – 20g = 76 g H2O
CpII = 40,5 %
MrII = 127,7 g
Zadanie 5
Odpowiedź
Vp = nRT
V- objetość
P – ciśnienie
n- liczba moli
R – stała gazowa (83,1)
N = (V*p)/(R*T)=0,06 mol
Ms = 75g
Mr = 175g
M H2O2 = 34 g/mol
2 * 34 g H2O2 —— 1 mol O2
X g —— 0,06 mol O2
X = 4,08 g
Przereagowało 4,08g H2O2
68 g H2O2 —— 2 * 18 g H2O
4,08 g ——— x
X = 2,16 g
Przereagowało 4,08g H2O2 i powstało 2,16 g H2O
Cp = 40%
40% – 30% = 10%
Odp : Wzrosło o 10%
Zadanie 6
Odpowiedź
AlCl3 + 3NaOH —-à Al(OH)3 + 3NaCl
Al(OH)3 + NaOH à Na[Al(OH)4]
Na[Al(OH)4] —–à NaAlO2 + 2H2O
M AlCl3 = 135,5 g/mol
M NaOH = 40 g/mol
135,5 g —– 120g
30g ——– x
X = 27 g (NaOH użyte do rozpuszczenia chlorku glinu)
M Al(OH)3 = 78 g/mol
133,5 g – 78 g
30 g —- x g
X = 17,5 g ( Al(OH)3, które powstało w tej reakcji)
78 g – 40 g
17,5 g —– x g
X = 9g (NaOH użyte do rozpuszczenia Al(OH)3 )
M Na[Al(OH)4] = 118 g/mol
78 g – 118 g
17,5 g — x g
X = 26,5g (Na[Al(OH)4] powstałe w reakcji )
M NaAlO2 = 82 g/mol
82 g –—118 g
2,7 g —- x g
X = 3,89 g(Na[Al(OH)4] które uległo rozpadowi)
Masa wody powstałej podczas rozpadu Na[Al(OH)4] :
118 g —— 2 * 18
3,89 g —— x g
X = 1,2g H2O
Masa pozostałego Na[Al(OH)4] = 26,5 – 3,89=22,61 g
Masa wody = 120 + 1,2 = 121,2 g
Cp = 15,72%