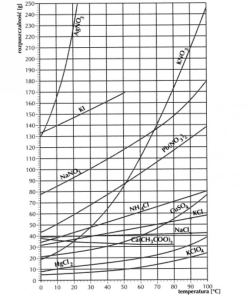
Tabela rozpuszczalności potrzebna do zadań :
Zadanie 1
Zad 1
W trzech probówkach znajdują się wodne roztwory chlorku sodu, z czego jeden z nich jest nasycony, drugi rozcieńczony, a trzeci przesycony.
a) Zaproponuj doświadczenie, w którym rozróżnisz, jakie roztwory znajdują się w poszczególnych probówkach
b) Zaproponuj dwa sposoby, dzięki którym zamienisz 1) roztwór nienasycony; 2) roztwór przesycony na roztwór nasycony.
c) ile gramów NaCl znajduje się w probówce z 165 g roztworu nasyconego dla temperatury 303K
Odpowiedź
Patrzymy, na probówki, w jednej z nich możemy zauważyć wykrystalizowanie kryształki – w tej probówce znajduje się roztwór przesycony. Do dwóch pozostałych dodajemy kryształek NaCl. W jednej probówce kryształek się rozpuści, w drugiej opadnie na dno. W probówce, w której kryształek rozpuścił się znajduje się roztwór nienasycony, a w probówce, w której kryształek opadł na dno roztwór nasycony.
b)
1) I – dodając kryształki NaCl
II – odparowując wodę
2) I – dolewając wodę
II – podwyższając temperaturę
c) W 303 K roztwór nasycony zawiera ok. 37g NaCl, a cały roztwór ma masę 137 g.
137 g —— 37 g
165 g —— x g
X = (165*37) : 137 = 44,56 g NaCl
Zadanie 2
a) Jaki roztwór powstał po dodaniu wrzątku?
b) Oblicz wydajność procentową tego procesu
Odpowiedź
100 g ———— 75 g
200 g ———— x g
X = 150g CuSO4,
A więc po dodaniu do 200 g wody w temperaturze wrzenia 165g CuSO4,powstanie roztwór przesycony.
b )Obliczamy ile gramów soli zostanie w 200g wody w temp. 323 K
100 g ——– 35 g
200 g ——– x g
X = 70 g
W tej temperaturze w 200 g wody zostanie 70 g CuSO4,
Wykrystalizuje 150 – 70 = 80 g
Wydajność procentowa:
W = 80/165 * 100% = 48,47%
Zadanie 3
Odpowiedź
Zadanie 4
a) czy po dodaniu 30 gramów chloranu (V) potasu do 136g wody w temperaturze 333K powstanie roztwór nasycony.
b) Jeżeli nie, podaj 3 sposoby zamiany powstałego roztworu na roztwór nasycony.
Odpowiedź
100 g ——- 25 g
136 g ——- x g
X = 34 g
30 g < 34 g
Odp: Nie, powstanie roztwór rozcieńczony
b ) I- Obniżenie temperatury
II – odparowanie wody
III – dodanie 4 g KClO3
Zadanie 5
a) Oblicz ile gramów chlorku rtęci możemy dodać do tego roztworu, aby pozostał nadal roztworem nasyconym, jeżeli podniesiemy jego temperaturę o 35 K.
b) Oblicz ile gramów HgCl2 wykrystalizuje, jeżeli ochłodzimy powstały roztwór o 55 K.
Odpowiedź
100g —– 15 g
50 g ——- x g
X = 7,5 g
W 100g wody w temperaturze 363 K rozpuszcza się około 35g HgCl2 .
1900 g —— 35 g
50 g ——- x g
X = 17,5 g
17,5 – 7,5 = 10 g
Odp : Możemy dodać 10 g HgCl2 .
B ) W 100g wody w temperaturze 273 K rozpuszcza się około 8g HgCl2 .
100 g –—- 8 g
50 g —– x g
X = 4 g
7,5 – 4 = 3,5 g
Odp: Wykrystalizuje 3,5 g
Zadanie 6
Odpowiedź
W 100g wody w temperaturze 323 K rozpuszcza się około 88g KNO3 .
188 g ——- 88 g
173 g ——- x g
X = 81 g
a )Cp = 81/173 * 100% = 46,82 %
b )173 g H2O = 0,173 dm3
MKNO3 .= 101 g/mol
1 mol – 101 g
X mol – 81 g
X = 0,8 mol
CM = 0.8/0.173 = 4,62 mol/dm3
c) 173g = 0,173 dm3
Cm = 81/0.173 = 468,29 g/dm3