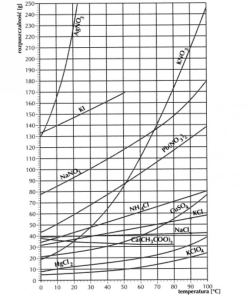
Tabela potrzebna do zadań
Zadanie 1
Zad 1
Dwie substancje A i B mają jednakową rozpuszczalność w pewnej temperaturze. Które ze stężeń: a) molowe b) procentowe tych dwóch substancji jest jednakowe. Odpowiedź uzasadnij.
Odpowiedź
Stężenie procentowe, gdyż jest to stosunek masy substancji przez masę roztworu. Jeżeli rozpuszczalność obydwóch substancji są takie same to ms i mr też są takie same a tym samym stężenie procentowe jest takie same.
Zadanie 2
Rozpuszczalność substancji A wynosi 20 g, a rozpuszczalność substancji B wynosi 200 g. Udowodnij, że stężenie molowe substancji A może być większe niż stężenie molowe substancji B, podaj potrzebne założenie.
Odpowiedź
a )CM = n/V
n- ilość moli w roztworze
V – objętość ( dla roztworów A i B przyjmijmy, że mają taką samą wartość)
N = ms/mM
ms – masa substancji
mM – masa molowa
msA = 20g
msB = 200g
CM1 > CM2
msA/(mMA*V) > msB/(mMB *V) / *V
20/mMA > 200/mMB
200 * mMA = 20 * mMB / : 20
mMB = 10 * mMA
Odp: Aby stężenie molowe substancji A było większe niż stężenie molowe substancji B to masa molowa substancji A musi być 10 razy mniejsza niż masa molowa substancji B.
n- ilość moli w roztworze
V – objętość ( dla roztworów A i B przyjmijmy, że mają taką samą wartość)
N = ms/mM
ms – masa substancji
mM – masa molowa
msA = 20g
msB = 200g
CM1 > CM2
msA/(mMA*V) > msB/(mMB *V) / *V
20/mMA > 200/mMB
200 * mMA = 20 * mMB / : 20
mMB = 10 * mMA
Odp: Aby stężenie molowe substancji A było większe niż stężenie molowe substancji B to masa molowa substancji A musi być 10 razy mniejsza niż masa molowa substancji B.
Zadanie 3
Wodę o temperaturze 273K nasycono powietrzem. Rozpuszczone gazy usunięto z roztworu przez ogrzewanie do temperatury wrzenia. Otrzymano mieszaninę o składzie procentowym 65,7% azotu, 34,4 % tlenu i 2,3% dwutlenku węgla.
a) Dlaczego otrzymana mieszanina ma inny skład procentowy niż powietrze?
b) O ile punktów procentowych różnią się objętości otrzymanej mieszaniny od objętości powietrza.
a) Dlaczego otrzymana mieszanina ma inny skład procentowy niż powietrze?
b) O ile punktów procentowych różnią się objętości otrzymanej mieszaniny od objętości powietrza.
Odpowiedź
a) Ponieważ rozpuszczalność gazów w wodzie jest różna, dlatego woda w różnym stopniu wysyciła się tymi gazami. Rozpuszczalność tlenu jest większa niż azotu, dlatego jest go relatywnie więcej po usunięciu gazów z wody.
b) Azot : 12,3%
Tlen : 13,4%
Dwutlenek węgla: 2,26%
b) Azot : 12,3%
Tlen : 13,4%
Dwutlenek węgla: 2,26%
Zadanie 4
Ile gramów piętnastowodnego siarczanu glinu użyto do sporządzenia 135 g roztworu o stężeniu procentowym 20%
Odpowiedź
Al2(SO4)3 * 15 H2O
M Al2(SO4)3 = 342 g/mol
M H2O = 18 g/mol
CpH = 342/(342+15*18) * 100% = 56%
x- masa hydratu
y – masa wody
x * 56% + y * 0% = 135 * 20%
56x = 2700 / : 56
X = 48,21 g
M Al2(SO4)3 = 342 g/mol
M H2O = 18 g/mol
CpH = 342/(342+15*18) * 100% = 56%
x- masa hydratu
y – masa wody
x * 56% + y * 0% = 135 * 20%
56x = 2700 / : 56
X = 48,21 g
Zadanie 5
Czy stężenie molowe roztworu soli uwodnionych, a soli nieuwodnionych jest takie samo?
Odpowiedź
a ) Nie, ponieważ sole uwodnione zawierają dodatkowe cząsteczki wody, które zwiększają objętość roztworu, a taka sama liczba moli substancji podzielona przez różne objętości roztworu tych soli daje nam różne stężenia molowe.
Zadanie 6
Co zrobić, aby z napojów gazowanych nie wydzielał się gaz?
Odpowiedź
Obniżyć temperaturę napoju, ponieważ obniżając temperaturę zwiększamy rozpuszczalność dwutlenku węgla, przez co nie wydziela się on z napoju.
Zbiór zadań maturalnych:
- czy stężenie molowe roztworu soli uwodnionych jest takie samo
- https://matura biomist pl/chemia/page/3